Arbeitsgruppe Translationale Neurodegeneration
Neurodegenerative Erkrankungen sind Alterserkrankungen, d.h. ihre Inzidenz steigt mit dem Lebensalter kontinuierlich an. Durch die zunehmende Lebenserwartung der Bevölkerung werden neurodegenerative Erkrankungen neben Tumorerkrankungen und Herz-Kreislauferkrankungen die größte Gruppe der altersbedingten Erkrankungen einnehmen. Diese sind bisher nicht heilbar und der Verlauf nur marginal beeinflussbar. Somit stellen neurodegenerative Erkrankungen eine enorme gesellschaftspolitische und finanzielle Herausforderung der Zukunft dar.
Neurodegenerative Erkrankungen sind assoziiert mit z.T. entitätsspezifischer amyloid-artiger Proteinaggregation, dennoch sind die Natur der Aggregate und deren pathophysiologische Relevanz bislang nicht vollständig geklärt. Es gibt sowohl nukleäre Aggregation (z.B. Huntington) als auch zytoplasmatische Aggregation (Alzheimer, ALS, Parkinson). Diese Kompartmentspezifität scheint eine entscheidende Rolle in der Pathophysiologie zu spielen, da Aggregation im Zytoplasma zu einer Störung des nukleozytoplasmatischen Protein- und RNA Transportes führt, nukleäre Aggregation jedoch nicht. Diese neurodegenerativen Mechanismen sind sehr wahrscheinlich auch für die Selektivität und die Art der Pathologieausbreitung der verschiedenen neurodegenerativen Erkrankungen verantwortlich.
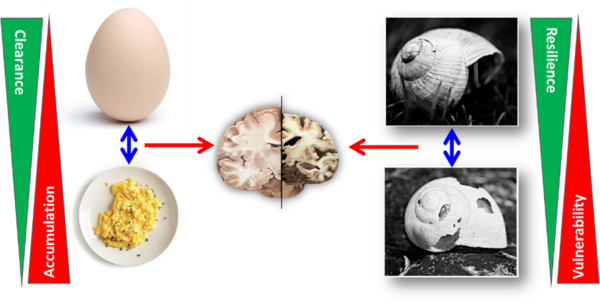
Die Altersabhängigkeit weist – neben den ggfs. entitätsspezifischen Krankheitsmechanismen – Faktoren des gesunden und/oder krankhaften Alterns eine wesentliche Rolle in der Pathophysiologie dieser Erkrankungen zu. Damit bieten sich drei unterschiedliche aber sich ergänzende Strategien zur krankheitsmodifizierenden therapeutischen Intervention bei Neurodegenerativen Erkrankungen an:
- Stärkung gesunder Alterungsprozesse zur Stärkung der Resilienz (Widerstandsfähigkeit gegen neurodegenerative Insulte)
- Reduktion bzw. Verlangsamung krankhafter Alterungsprozesse
- Therapie der Neurodegenerativen Erkrankung durch Intervention in deren Pathophysiologie
Diese drei Strategien dürfen nicht isoliert betrachtet werden, sondern gerade die Kombination der drei Ansätze erscheint für das Feld der Neurodegeneration eine äußerst attraktive Lösung. Dies insbesondere auch aufgrund der Tatsache, dass viele Mechanismen, die aktuell für Neurodegeneration (mit-)verantwortlich gemacht werden, typischerweise im Alter zunehmen. So wird beispielsweise Autophagie mit zunehmendem Lebensalter ineffektiver; eine Steigerung dieser bewirkt im Mausmodell eine Lebenszeitverlängerung. Ähnliches gilt für die Proteostase, die DNA-Reparatur und den gesamten mitochondrialen Stoffwechsel.
Unsere Gruppe hat eine Hypoexzitabilität in ALS-mutierten Motoneuronen identifiziert, die durch eine 4-AP-Behandlung gerettet werden konnte (Naujock et al., Stem Cells. 2016) und wir haben dies klinisch umgesetzt und erste Patienten damit behandelt (Peikert et al., J Clin Pharmacol 2019). Kürzlich haben wir bedeutende Fortschritte bei der Identifizierung von DNA-Schadensreparaturdefiziten als neuartiges Upstream-Ereignis bei der ALS gemacht, das der Aggregation und Neurodegeneration vorausgeht und diese induzieren kann (z. B. Naumann et al., Nat Comm 2018, Kreiter et al. Neurobiol Dis 2018, Pal et al, Sci Data 2019). Dies führte jedoch nicht zu einer generellen Genotoxizität (z.B. Tumorbildung) bei ALS-Patienten (Naumann et al., Ann Clin Transl Neurol. 2019).
Darüber hinaus ist es uns gelungen, die pathophysiologische Kaskade der VPS13A/Chorea-Acanthozytose (ChAc) zu entschlüsseln, indem wir eine erhöhte Aktivität der Lyn-Kinase und einen molekularen Zusammenhang zwischen aktivem Lyn und gestörter Autophagie nachweisen konnten und dass die TKis Dasatinib oder Nilotinib den ChAc-Phänotyp in menschlichen ChAc-abgeleiteten Zellen und in Vps13a-/- Mäusen retten können (Stanslowsky et al. J Neurosci 2016, Lupo F et al., Blood 2016). Wir leisteten Pionierarbeit mit einem ersten individuellen Off-Label-Behandlungsansatz beim Menschen mit dem FDA- und EMA- zugelassenen TKi Dasatinib bei drei freiwilligen Patienten mit ChAc. Die Dasatinib-Behandlung (Dauer 25,8-50,4 Wochen) war sicher und gut verträglich. Die klinischen Ergebnisse blieben stabil und es wurde eine Reduktion von abnormal aktivierter Lyn-Kinase und Autophagie-Markern in Erythrozyten gefunden (Peikert et al., J. Pers. Med. 2021).
Unser zukünftiges Ziel ist es, durch die Kombination der oben genannten Strategien kausale Therapien von neurodegenerativen Erkrankungen zu entwickeln (Abbildung). Um diese Ziele zu erreichen, nutzt unsere Gruppe das gesamte Spektrum der klinischen Forschung von der Grundlagenforschung bis zur patientenorientierten Forschung. Wir verbinden langjährige Traditionen der neurowissenschaftlichen Forschung an der Universitätsmedizin Rostock bei der Bearbeitung neurodegenerativer Erkrankungen mit modernen humanen stammzellbasierten Zellsystemen. Dies beinhaltet vor allem den Einsatz patientenspezifischer Modelle und die Entwicklung individualisierter Therapiestrategien für neurodegenerative Erkrankungen in einem bidirektionalen klinischen Translationsansatz.

AG Translationale Neurodegeneration
Prof. Dr. Dr. Andreas Hermann (AG-Leiter)
Dr. Hannes Glaß (PostDoc)
Dr. Dajana Großmann (PostDoc)
Dr. Christiane Hartmann (PostDoc)
Dr. Marcel Naumann (Clinician Scientist)
Dr. Kevin Peikert (Clinician Scientist)
Dr. Alexandra Jürs (Clinician Scientist)
Dr. Muhammad Ismail (Medical Scientist)
Anna E. Bartalis (PhD Studentin)
Di Wu (PhD Student)
Annaliis Lehto (PhD Student)
Anze Karlek (PhD Student)
Leonarda Vucic (PhD Student)
Ece Eldem (PhD Student)
Constantin Minkner (Med. Doktorand)
Gael Nils Tarakdjian (Med. Doktorand)
Helene Block (Med. Doktorandin)
Nina Malburg (Med. Doktorandin)
Adrian Spranger (Med. Doktorand)
Christina Haß (Med. Doktorandin)
Emily Fischer (Med. Doktorandin)
Helene Block (Med. Doktorandin)
Jona E. Brüning (Med. Doktorandin)
My Dang Thi (Med. Doktorandin)
Anna-Lena Fuchs (Med. Doktorandin)
Lea Hellberg (Med. Doktorandin)
Henri Maierhof (Med. Doktorand)
Maite Peters (Med. Doktorandin)
Lorenz Reuter (Med. Doktorand)
David Sander (Med. Doktorand)
Jan Suchy (Med. Doktorand)
Jannes Wahl (Med. Doktorand)
Theresa Wierschin (Med. Doktorandin)
Louisa Winkelmann (Med. Doktorandin)





Video: Live-Cell-Fluoreszenz-Mikroskopie an humanen Motoneuronen, die die ALS-assoziierte FUS-Protein-Mutante mit angefügtem EGFP exprimieren. Zur Induktion von oxidativem Stress wurden die Zellen mit Natriumarsenit behandelt. Zu sehen ist das grün fluoreszierende FUS in sich bildenden Stress-Granulae.
Video: Zu sehen sind in mikrofluiden Kammern kultivierte Motoneurone, in deren Zellkernen mit einem definierten Laserschnitt DNS Schaden induziert wurde. Bei gezielter Störung der Mikrotubuli-Polymerisierung (24 Stunden, 5µM Nocodazole, Mitte) oder Inhibition der Atmungskette (Komplex V, 24 Stunden, 10µM Oligomycin A, Unten) ausschließlich im distalen Zellbereich wird Wildtyp FUS-eGFP (grün) am Laserschnitt (Kästchen) in proximal gelegenen Zellkernen rekrutiert. Bemerkenswert ist die unveränderte Rekrutierung von FUS in proximal gelegenen Zellkernen trotz deutlicher Beeinträchtigung des distalen Netzwerks der Mitochondrien und ihrer Beweglichkeit (MitoTracker Deep Red FM, rot) infolge der Behandlungen.
